近日,南开大学生命科学学院生物活性材料教育部重点实验室孔德领教授团队在Advanced Science期刊(IF: 15.804)发表了题为“Targeted Repair of Vascular Injury by Adipose‐Derived Stem Cells Modified with P‐Selectin Binding Peptide”的研究论文。该研究是利用两亲性分子DMPE-PEG结合P-选择素靶向多肽(PBP)对细胞膜表面进行修饰,提高脂肪来源间充质干细胞(ADSCs)对活化的血管内皮以及激活的血小板表面的靶向结合能力,从而提高干细胞移植对血管损伤部位的治疗效果。(图1)。
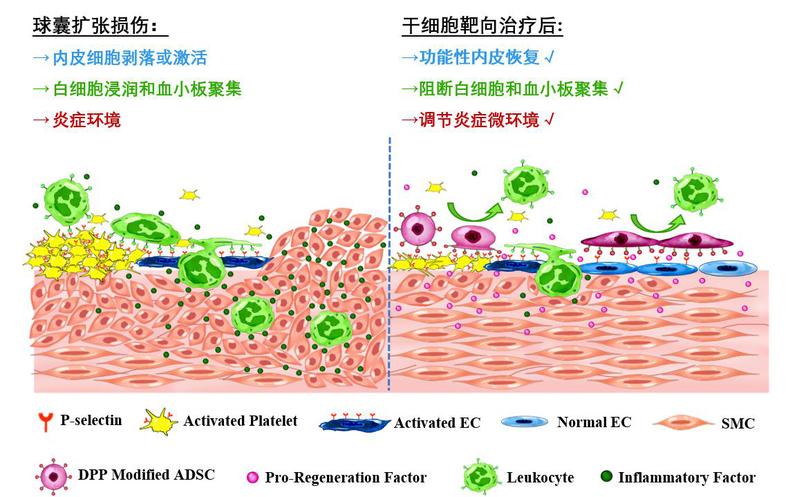
图1. DMPE-PEG-PBP(DPP)分子修饰ADSCs靶向治疗血管损伤示意图。
经皮冠状动脉介入治疗(PCI)是目前临床上治疗动脉阻塞最常用的手段之一,但这类手术往往会造成血管内皮剥落或气压伤等血管壁损伤。研究表明,ADSCs具有内皮分化、免疫调节和生长因子分泌等功能。如果通过静脉输入ADSCs,能够到达血管损伤部位的细胞数量很少,疗效甚微。本研究利用细胞表面工程化修饰手段,在细胞膜表面插入靶向识别P-选择素蛋白的向肽PBP。在体外实验中,工程化修饰的ADSCs对P-选择素分子高表达的活化内皮细胞和激活的血小板具有显著增强的靶向性,对新鲜损伤的动脉血管内皮具有强的靶向性结合与修复。
在体内实验中,对大鼠股动脉进行损伤,通过静脉输入DPP-ADSCs,与不治疗组和未修饰的ADSCs治疗组相比,DPP修饰的干细胞治疗组动脉血管的新内膜增生、管腔再狭窄得到显著抑制,功能性血管内皮(eNOS+)快速再生(图2)。
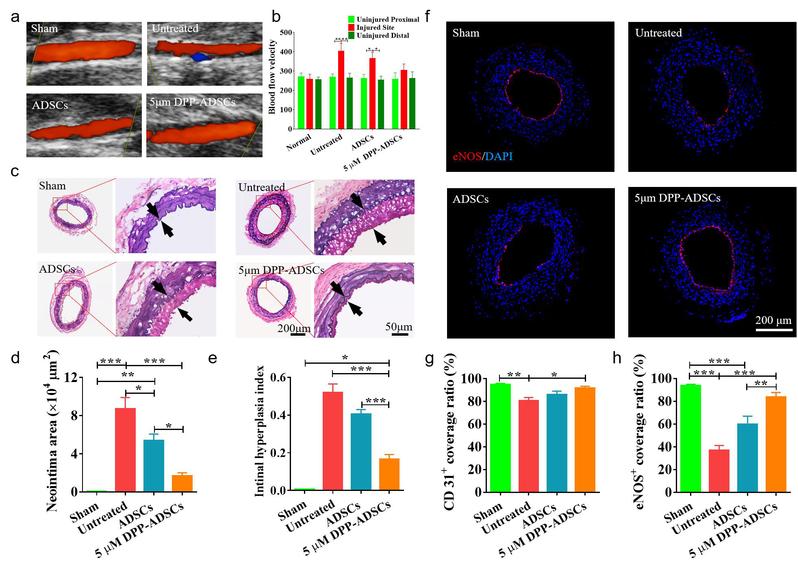
图2. DPP-ADSCs有效治疗大鼠股动脉损伤
ADSCs在损伤的血管表面高效粘附,在局部分泌多种活性因子,有效地调节了被损伤活化的内皮细胞(图3 a-c)。此外,屏蔽了血液中炎症细胞和血小板在血管损伤部位的进一步黏附,减轻了局部炎症反应,从而有效抑制了损伤血管的内膜增生。
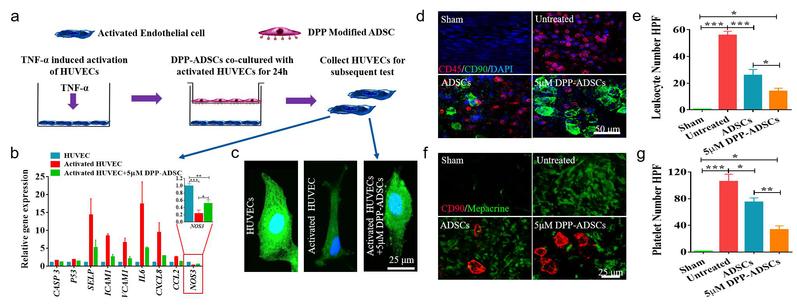
图 3. DPP-ADSCs修复内皮细胞功能(a-c),屏蔽白细胞(d-e)与激活血小板(f-g)的进一步黏附
该论文由南开大学生命科学学院博士生闫泓雨与硕士生米杏妍为共同第一作者,王恺副教授、孔德领教授和博士后朱美峰为本论文的共同通讯作者。
论文链接:https://onlinelibrary.wiley.com/doi/pdfdirect/10.1002/advs.201903516
本研究得到了创新研究群体项目(81921004),国家自然科学基金重点项目(81530059)等的支持。



