
7月28日,南开大学生命科学学院、药物化学生物学国家重点实验室韩际宏教授领导的研究团队在肝脏研究领域的国际顶级期刊《肝脏病学》(Journal of Hepatology)上在线发表了最新研究成果,首次阐明了减少Nogo基因表达能够抑制高碳水化合物食物引起的葡萄糖不耐受和胰岛素抵抗,同时增加糖、脂的利用,增加能量消耗,从而抑制由高碳水化合物食物引起的体重增加、肝脏脂质积累以及相关的代谢紊乱。这一发现,有望使Nogo基因成为治疗代谢疾病的新靶点。
近年来愈来愈多的研究成果表明长期过量摄入碳水化合物,尤其是高糖类(如葡萄糖、果糖、蔗糖等)食物会导致代谢综合征,例如肥胖、胰岛素抵抗、非酒精性脂肪性肝病等发生。随着代谢综合征患病率的升高,揭示不同营养条件下调控糖脂代谢的新通路将为糖脂代谢紊乱的精准干预提供新靶点。
研究人员发现,高碳水化合物食物通过激活碳水化合物反应元件结合蛋白 (ChREBP)和降低胰岛素敏感性造成野生型小鼠肝脏脂肪变性和代谢紊乱。同时,高碳水化合物食物通过刺激Nogo-B基因表达进一步加剧胰岛素抵抗。与野生型小鼠相反,高碳水化合物食物在Nogo基因敲除小鼠中无法刺激肝脏Nogo-B基因表达,表现为肝脏Nogo-B基因的缺失增强胰岛素敏感性,降低ChREBP表达和活性以及脂质合成相关分子表达,并伴随着能量代谢相关基因的激活和能量代谢的升高,从而拮抗了由高碳水化合物食物诱导的肝脏脂质积累、胰岛素抵抗以及其他代谢紊乱。进一步,野生型小鼠注射Nogo小干扰RNA敲减肝脏Nogo-B也可显著改善高果糖饮食诱导的代谢损伤。
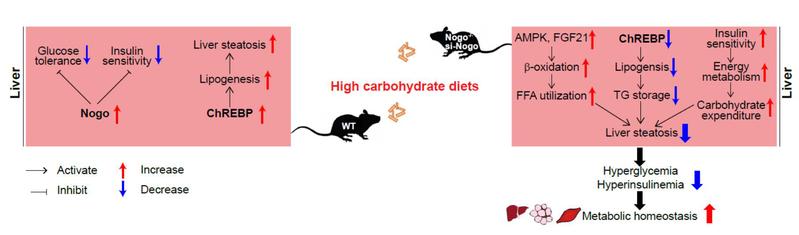
抑制Nogo改善糖脂代谢的分子机制示意图
综上,本研究阐明了一种新的调控糖脂转化的分子机制:在生理条件下,Nogo基因敲除能够适当地激活ChREBP,从而少量增加肝脏脂质水平,增强小鼠适应高能量需求环境;而在病理条件下,减少Nogo基因表达能够增加胰岛素敏感性、抑制ChREBP表达,从而抑制高碳水化合物食物引起的葡萄糖不耐受和胰岛素抵抗,同时增加糖和脂的利用,增加能量消耗。该研究发现了Nogo基因在糖脂代谢中的新功能,有望成为治疗代谢性疾病的新靶点。
据了解,该成果由南开大学联合合肥工业大学、纽约大学、耶鲁大学等研究团队一同完成,南开大学2020届博士毕业生张爽为论文第一作者。该工作得到国家自然科学基金,政府间国际科技创新合作重点专项等基金的共同资助。
论文链接:https://pubmed.ncbi.nlm.nih.gov/32738448/



