促红细胞生成素(EPO)是调控红细胞成熟分化、抑制凋亡的最主要的细胞因子。成体EPO主要是由肾脏中EPO分泌细胞(REP)产生。临床上由于REP功能异常导致EPO产生不足引发贫血为肾性贫血。慢性肾脏病(CKD)是全球性公共健康问题,其发病率约占据世界人口13.4%,患者死亡率高,生存质量差。其中肾性贫血是CKD患者最主要的并发症之一(发病率约占CKD的50%),也是导致CKD患者死亡率倍增的重要原因之一。深入研究肾脏EPO合成调控机制对深刻认知该类疾病及开发新的治疗靶点具有重要意义。
2021年5月4日,中国医学科学院血液病医院(中国医学科学院血液学研究所)石莉红课题组联合南开大学陈佺课题组、朱玉山课题组在eLife报道发现线粒体自噬参与调控EPO产生,并提出了以线粒体自噬为靶向的潜在治疗肾性贫血新思路。
利用Fundc1-/-小鼠,发现在生理条件下FUNDC1介导的线粒体自噬并不参与红细胞成熟过程中线粒体清除。但意外发现其参与药物诱导急性溶血性贫血的发生,表现为Fundc1的缺失导致了EPO生成减少,贫血加剧,小鼠的生存率降低;而EPO补给则显著改善了其贫血的表型。分子机制分析发现,FUNDC1缺陷导致了损伤线粒体清楚障碍与累积,进而引起了细胞内ROS水平上升与炎症信号激活,REP细胞转换为成纤维细胞从而丧失了EPO分泌能力。同时研究也证明了FUNDC1介导的线粒体自噬能够保护不同压力应激模型(单侧输尿管梗阻 (UUO)模型和肾性贫血模型)中EPO生成。该研究显示线粒体质量控制是肾性贫血中EPO生成的关键调控环节,提出靶向线粒体自噬潜在治疗新策略。
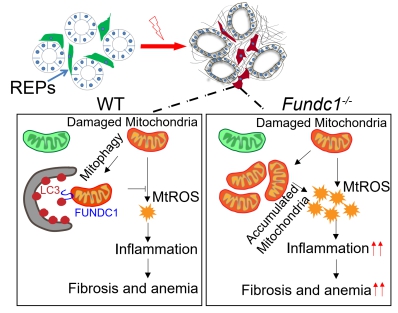
图释:FUNDC1在应激条件下保护肾脏 EPO 分泌细胞的生理功能
陈佺教授、朱玉山教授深耕线粒体生物学领域多年,主要研究方向为线粒体在细胞凋亡中的关键作用及线粒体自噬的分子调控机制。中国医学科学院血液病医院(中国医学科学院血液学研究所)石莉红团队主要围绕红细胞生理及病理机制进行研究。双方精诚合作,优势互补,全面揭示了FUNDC1介导的线粒体质控在EPO合成中的作用和内在分子机制,为肾性贫血的治疗提供了新的靶点及思路。
南开大学博士研究生耿广锋、中国医学科学院血液病医院(中国医学科学院血液学研究所)助理研究员刘金花和博士研究生徐长禄为该文章共同第一作者;中国医学科学院血液病医院(中国医学科学院血液学研究所)石莉红教授,南开大学陈佺教授、朱玉山教授为本文的共同通讯作者。该研究得到科技部重点研发计划、国家自然科学基金和中国医学科学院医学创新工程的资金支持。
全文链接:https://elifesciences.org/articles/64480



