近日获悉,南开大学生命科学学院龙加福/周浩课题组在滑膜肉瘤融合蛋白SS18-SSX致癌活性的机制研究中取得重要进展。5月18日,国际著名综合类学术期刊《自然•通讯》(Nature Communications)在线发表题为——“Phase transition and remodeling complex assembly are important for SS18-SSX oncogenic activity in synovial sarcomas”的文章,揭示了SS18-SSX结合染色质重塑复合物的结构基础及阐释了致癌融合蛋白SS18-SSX通过相分离促进细胞恶性转化的机制。

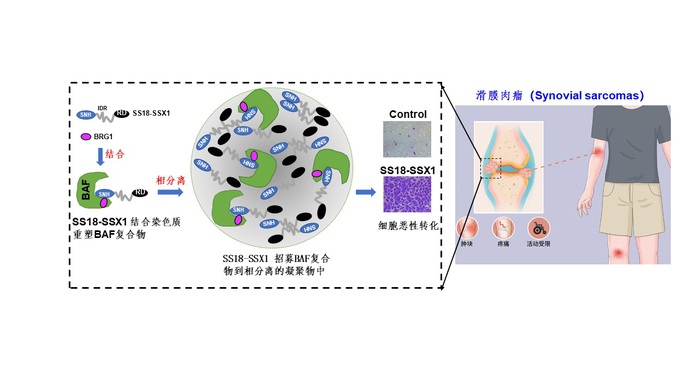
滑膜肉瘤是一种罕见的、好发于青少年和青年人中的软组织恶性肿瘤。已有证据表明90%以上的滑膜肉瘤都存在染色体易位导致的融合蛋白SS18-SSX的形成。迄今为止,SS18-SSX被认为通过与SS18竞争结合染色质重塑复合物来发挥关键的致癌作用,但相互作用的结构细节缺乏。同时,长期的对于SS18-SSX融合基因的研究都发现,SS18-SSX融合蛋白在细胞内形成斑点聚集现象,这现象对于其功能的发挥是否有重要作用,目前不明确。
课题组通过多年的潜心研究,综合利用生物化学、结构生物学和细胞生物学的技术,首先解析了哺乳动物染色质重塑cBAF复合物中人源SS18-SSX1/BRG1异二聚体的晶体结构,阐明了SS18-SSX1整合到cBAF复合物中的结构基础。研究还发现,SS18-SSX1蛋白中的QPGY结构域可以通过酪氨酸残基介导多价相互作用来调节SS18-SSX1多聚化及细胞内斑点的形成。进一步的体外和体内实验结果表明,QPGY结构域介导SS18-SSX1的液-液相分离,从而将ATP酶亚基BRG1招募到相分离的凝聚物中。后续的研究发现SS18-SSX1的相分离功能或者与BRG1的结合均对SS18-SSX1蛋白的致癌活性起到关键作用。文章结果表明,SS18-SSX1通过相分离介导募集染色质重塑cBAF复合物调控下游癌基因的转录,进而推动滑膜肉瘤发生发展,为后续开发治疗滑膜肉瘤的相关药物奠定了基础。
该成果由南开大学药物化学生物学国家重点实验室、生命科学学院龙加福教授团队完成,龙加福教授和周浩副教授是该论文共同通讯作者,龙加福教授实验室的2017级博士研究生程艳丽为论文第一作者。该研究得到了国家自然科学基金项目、天津市及深圳市自然科学基金的资助。
论文链接:https://www.nature.com/articles/s41467-022-30447-9



