日前,南开大学生命科学学院暨药物化学生物学国家重点实验室赵强教授课题组在生物复合人工血管的制备及其组织再生调控方面取得新进展。团队提出人工血管通过局部释放一氧化氮(NO)改善组织再生重构的新策略,并设计制备了具有NO缓释功能的生物复合型人工血管。该血管能够在体内环境中转化产生NO,有效调控内源性血管干/祖细胞命运,促进血管组织再生并抑制血管钙化。相关研究成果以“Nitric oxide improves regeneration and prevents calcification in bio-hybrid vascular grafts via regulation of vascular stem/progenitor cells”为题发表在Cell Reports上(2022, 39:110981)。
心血管疾病(CVD)因其高发病率和高死亡率,已成为全球范围内重大公共卫生问题。血管旁路移植术(Bypass grafting)是目前治疗冠心病和外周血管疾病的重要手段。临床手术使用的桥血管多取自患者自身,包括桡动脉、内乳动脉和大隐静脉等。自体血管由于长期通畅率高,成为临床治疗的“金标准”。但是由于血管来源限制,而且会带来二次创伤,亟需发展用于替代的人工血管。
近年来,动物(猪)来源的天然血管由于其来源广泛,并具有与人血管类似的尺寸,受到了广泛关注。其可经过去细胞化处理消除免疫原性,并保留良好的细胞外基质成分和结构。在该工作中,研究人员将天然细胞外基质与静电纺丝人工血管结合,设计了一种具有缓释一氧化氮功能的生物复合型人工血管。该血管具有双层结构,内层为去细胞化处理的猪大隐静脉,其可提供良好的生物相容性和再生活性;外层则采用课题组前期研发的硝酸酯酯功能化材料(中国发明专利: ZL201810739149.X;Nat Commun 2021, 12:4501)可以起到力学支撑的作用,复合血管的力学强度和爆破动脉压可达到或接近天然动脉的水平。更重要的是,硝酸酯材料可以在体内环境中通过多步反应转化生成NO。在小鼠和兔子模型中,复合人工血管局部释放的NO可以有效改善血管组织再生,促进内皮化形成,并抑制内膜增生和血管钙化等病理性血管重构,显著提高血管长期通畅性。
研究团队还进一步利用谱系示踪技术并结合体外细胞实验,考察了内源性血管干/祖细胞(stem/progenitor cell, SPC)在血管组织再生重构中的关键作用和调控机制。结果显示:NO通过调控SPC向血管内皮细胞方向分化并抑制其向成骨分化,从而起到促进血管再生、抑制血管钙化的作用机制。进一步研究还发现,NO对于SPC向成骨细胞分化具有双向调节作用,低浓度(nmol~μmol)NO可通过调控TGF-pSMAD2/3信号通路,抑制SPC向成骨细胞分化,进而减少血管钙化形成;而高浓度NO(mmol)则起到截然相反的作用。这些研究结果充分证明NO在调控血管干/祖细胞命运促进血管组织再生方面具有重要作用,缓释NO的生物复合型人工血管具有良好的临床转化前景。
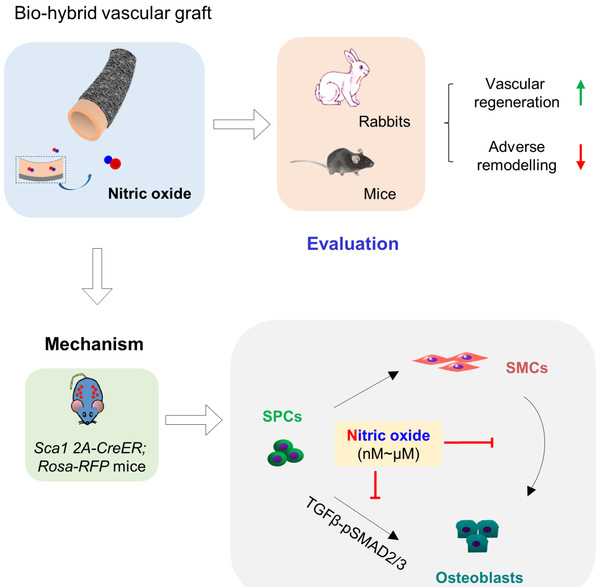
缓释一氧化氮的生物复合型人工血管的制备评价和体内再生机制
南开大学生命科学学院暨药物化学生物学国家重点实验室赵强教授与浙江大学医学院第一附属医院徐清波教授为本文的共同通讯作者,南开大学生命科学学院博士研究生王飞、秦康、副教授王恺和博士生王贺为本文共同第一作者。该工作得到了国家自然科学基金(81925021, 81921004, 81871500)和天津市自然科学基金(18JCJQJC46900)的支持。
论文链接:
https://www.cell.com/cell-reports/fulltext/S2211-1247(22)00767-7



