近日,南开大学生物伯苓班2016级校友、加州理工学院博士生王童彤以第一作者在国际顶级期刊《自然》(Nature)上发表论文《Organ-specific sympathetic innervation defines visceral functions》,加州理工学院Yuki Oka教授为论文通讯作者。
近年来,神经生物学领域不再仅仅关注大脑本身,而是逐步拓展到遍布全身的外周神经系统。我们日常生活中,呼吸、心跳、消化等生理过程都能在无意识状态下顺利进行,这得益于自主神经系统的精准调控。其分为交感(sympathetic)和副交感(parasympathetic)两个功能相反的体系:前者在紧急时刻触发“战斗或逃跑”(Fight or Flight)反应,将资源优先分配给心肺和肌肉等关键部位;后者在安稳环境下主导“休息与消化”(Rest and Digest),促进胃肠活动、能量储备和废物排出。
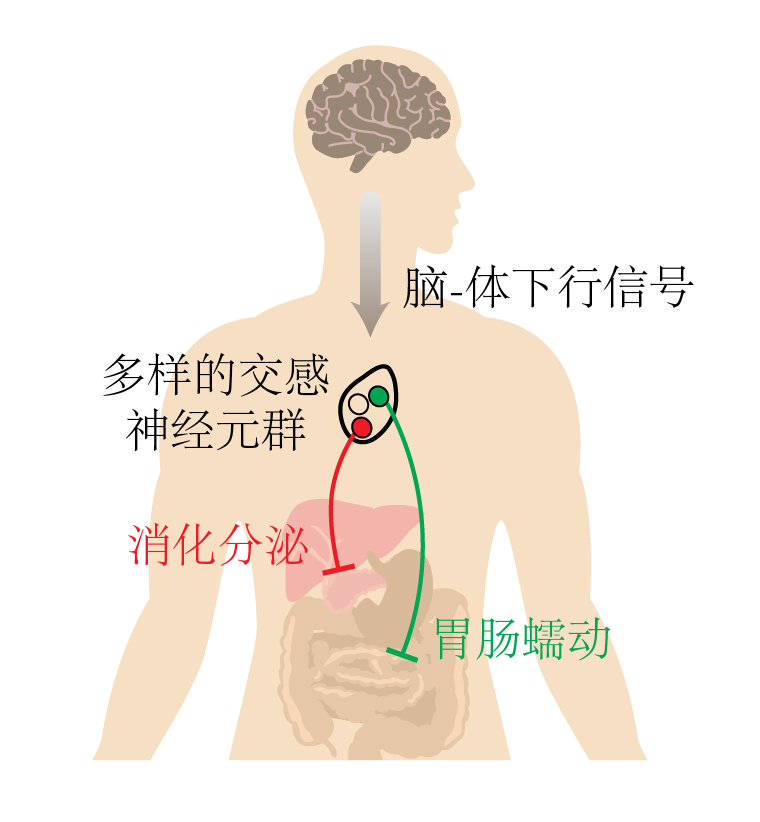
“教科书上对于自主神经系统的描述还非常的笼统,交感神经被认为广泛一致地影响全身内脏器官,”王童彤解释道,“但我们发现实际上远比“全面激活”更精细化,有非常多样的交感神经元群专门负责不同的器官功能“。
此项研究聚焦于腹部交感神经系统中的腹腔-上肠系膜神经节(celiac-superior mesenteric ganglia, CG-SMG),利用单细胞转录组测序和空间转录组实验,在分子层面上鉴定出至少两类神经元群体,它们在基因表达水平上表现出显著的差异。进一步,研究团队运用转基因小鼠进行遗传示踪,发现这两类神经元的轴突投射并不重叠:一类神经元主要连接胃肠道,调控胃肠运动;另一类则掌管胰腺、肝脏胆管等分泌相关器官。
研究总结示意图
为了探索这些神经元的具体功能,研究团队采用了光遗传学和化学遗传学技术,分别激活不同神经元群并监测相应器官的生理变化。由于许多内脏功能难以实时观测,他们与加州理工学院Wei Gao教授实验室合作研发了微流控装置,可精准监测在体胆汁分泌量。结果显示,激活负责肝脏和胰腺的神经元群后,胆汁分泌被抑制,胰高血糖素则明显上升;而激活投射至胃肠道的另一类神经元群后,则会显著抑制消化道蠕动。这些差异性功能表明,交感神经系统是以“模块化”方式来精准掌控各个器官活动。
这一研究对我们理解身体平衡稳态的维持机制具有深远意义。模块化神经结构使得机体能更高效地分配资源,应对各种生理需求。此外,该发现还有助于开发靶向治疗手段。许多慢性病,例如高血压、胃肠功能紊乱、代谢综合征等,都与交感神经活动异常有关。如果能精准锁定并干预负责“错误反应”的神经元群,而不干扰其他功能,副作用将大大降低。
此项工作的第一作者王童彤,本科毕业于南开大学基础学科拔尖学生培养计划——伯苓学院生物伯苓班。在学期间,曾以第二作者身份发表Nature论文,2020年圆满完成学业从南开大学毕业,并在多个美国名校全额奖学金博士offer中,选择了赴美国加州理工学院进行博士学习和深造。攻读博士学位期间,致力于脑与外周神经系统调节动物行为和机体生理反应的机制,研究成果发表于Nature, Cell, Neuron等国际顶级期刊。
“我非常幸运地能在生物伯苓班进行本科学习,低年级阶段广泛而丰富的课程不仅拓宽了我对科学研究各领域的了解,也激发了我的兴趣;高年级后深入而严谨的科研训练则为我之后的进一步科学探索奠定了坚实基础。”王童彤回忆说。
论文链接:https://www.nature.com/articles/s41586-024-08269-0



