锌激活通道(ZAC)是一种非典型的哺乳动物半胱环受体(CLR),由锌离子和质子激活,允许阳离子通过。配体激活ZAC的分子机制仍然难以捉摸。
2025年1月7日,南开大学生命科学学院沈月全、杨雪、林建平及中国科学院遗传与发育生物学研究所陈宇航共同通讯在Nature communications 上在线发表题为“Structural insights into the activation mechanism of the human zinc-activated channel”的研究论文。研究提出了在不同条件下人ZAC(hZAC)的三种冷冻电子显微镜重建。

这三种hZAC结构彼此表现出高度相似的构象,形成具有中心离子传导孔的对称同源五聚体。hZAC原体由胞外结构域(ECD)和跨膜结构域(TMD)组成,与阴离子通透性clr(如甘氨酸受体和a型γ-氨基丁酸受体)具有更多的结构相似性。值得注意的是,hZAC具有独特的C尾,可与TMD中的环M2-M3建立二硫键,并占据其他哺乳动物CLR中通常的经典神经递质正构位点。此外,囊环的尖端在hZAC中创造了一个前所未有的正位位置。Zn2+的结合触发了cys-环的构象变化,这可能促使环M2-M3移动并打开通道门。本研究揭示了该通道在hZAC中的组装、结构特征和信号转导过程。
哺乳动物半胱氨酸环受体(CLR)是五聚体配体门控离子通道(pLGIC)超家族的一部分。它们作为神经递质门控离子通道发挥着关键作用,能够在中枢神经系统和外周实现快速突触和突触外神经传递。被公认为重要的治疗靶点,CLR功能障碍可导致身体疾病,并与多种疾病有关,包括阿尔茨海默病、精神分裂症和自闭症谱系。
哺乳动物CLR通常包括烟碱乙酰胆碱受体(nAChR)、3型5-羟色胺受体(5-HT3R)、甘氨酸受体(GlyR)、GABA(A)受体(GABAAR)。以前的结构研究已经阐明了它们的激活机制。CLR形成同源五聚体或异源五聚体,细胞外结构域(ECD)的配体结合触发跨膜结构域(TMD)的一系列构象变化,导致离子渗透。
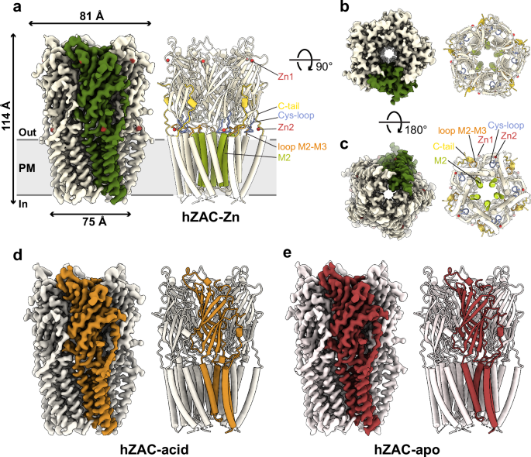
最近,已经确定了第五种哺乳动物CLR,即锌激活通道(ZAC)。ZAC表现出与以前已知的CLR不同的特征。作为一种非典型的阳离子选择性CLR,ZAC在各种人体组织中广泛表达。尽管大多数哺乳动物物种具有保守的直系同源ZACN基因,但这些基因在小鼠和大鼠中明显不存在。尽管与其他CLR的序列相似性相对较低(~20%),但ZAC同样组装成一个由ECD和TMD组成的五聚体。目前已发现ZAC可被锌(Zn2+)、质子(H+)和铜(Cu2+)激活,但对其详细的结构认识尚未建立,这阻碍了进一步的功能研究。在这项研究中,使用冷冻电子显微镜(Cryo-EM)确定了三种不同条件下全长人ZAC(hZAC)的高分辨率结构:未配体、锌结合和pH4.0。研究结果表明,hZAC形成具有重要C末端尾部构象的同型五聚体。



