癌症免疫治疗中,肿瘤相关抗原(TAAs)疫苗通过激活免疫系统对抗肿瘤,但其疗效依赖抗原呈递细胞高效捕获 TAAs。传统抗原捕获纳米材料存在两大瓶颈:一是需局部瘤内注射,无法适配位置不确定或者深部的肿瘤;二是多依赖疏水、静电等非共价作用结合 TAAs,易受血液中血清白蛋白竞争干扰,捕获效率低、稳定性差。此外,体外提取 TAAs 还存在抗原代表性不足、易变性等问题,开发可全身给药、肿瘤微环境(TME)特异性激活的高效共价抗原捕获平台,成为突破免疫治疗瓶颈的关键。

南开大学生命科学学院丁丹教授团队在《Journal of the American Chemical Society》发表相关研究,开发出肿瘤微环境激活型共价抗原捕获纳米平台。该平台以两亲性聚合物 DSPE-PEG2000为骨架,修饰过氧亚硝酸盐(ONOO⁻)响应的氟乙基苯硼酸酯,并封装光敏剂偶联的光激活雷西莫特(R848)前药,可实现全身给药后在肿瘤部位特异性激活,高效捕获 TAAs 并增强免疫应答,无需依赖局部注射,显著降低脱靶效应。
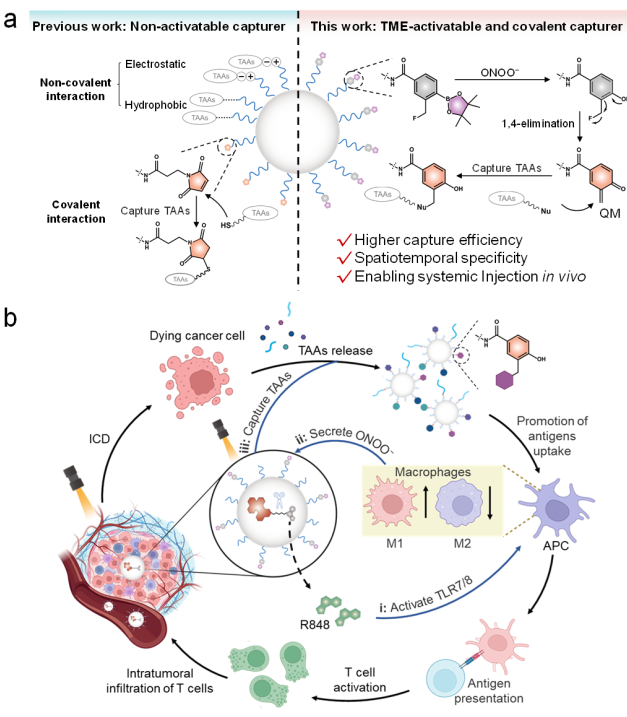
图1. a)非激活型与肿瘤微环境激活型抗原捕获纳米平台的示意图。
b)经全身给药和光照后,肿瘤微环境激活型抗原捕获及增强抗肿瘤免疫治疗的机制示意图。
经静脉注射后,抗原捕获纳米平台通过肿瘤血管高通透性和滞留效应在肿瘤部位富集。肿瘤内ONOO⁻触发氟乙基苯硼酸酯生成醌甲基化物(QM),以共价方式高效捕获 TAAs(结合效率 409.7 μg/mg,显著高于传统的马来酰亚胺官能团);光照射激活光敏剂产生单线态氧,既诱导肿瘤细胞免疫原性细胞死亡(ICD),释放 TAAs,又可控释放 R848 激活免疫。体内膀胱癌模型验证其能显著抑制肿瘤生长,并促进 M1 型巨噬细胞极化、激活细胞毒性 T 淋巴细胞,重塑肿瘤免疫微环境(图1)。
综上所述,该抗原捕获纳米平台通过肿瘤微环境响应的共价抗原捕获与光控免疫激活协同,有效解决了传统抗原捕获材料给药局限与结合效率低的问题,为全身给药的精准癌症免疫治疗提供了创新方案。
南开大学丁丹教授、科研助理辛景瑞和博士后赵记亮为论文的共同通讯作者。南开大学为论文第一单位。南开大学生命科学学院已毕业博士生高志远、南开大学医学院已毕业博士生苗志钊和南开大学生命科学学院博士后贾劭蕊为论文的共同第一作者。
原文链接:https://doi.org/10.1021/jacs.5c09791



